专注水质净化与环境改良
栏目分类
行业新闻
18974803966
【Nature】父系肠道微生物组干扰影响后代健康
撰稿 | 王柏凯
责编 | 刘 坚
2024年5月1日,欧洲分子生物学实验室(EMBL)Jamie A. Hackett团队在Nature杂志上发表了题为Paternal microbiome perturbations impact offspring fitness的文章。该研究表明,父代肠道微生物群的改变可通过影响精子质量和遗传特征,进而对后代的发育和健康产生负面影响。这揭示了微生物群在遗传和健康中的重要作用。

精子将可遗传的信息传递给下一代,这些信息包括基因(DNA序列)和表观遗传(非DNA序列)物质。跨物种的证据表明,表观遗传成分(如染色质状态、小RNA和大分子)有可能被受孕前环境修改,从而影响后代的表型。然而,哺乳动物中父系遗传的表观遗传效应的范围和机制仍不清楚,环境因素如何影响生殖细胞也是未知的。肠道微生物群在整合环境信号到宿主反应中的重要作用日益受到重视。事实上,哺乳动物的生命周期是在肠道微生物群的参与下进化的,这些微生物群在代谢、激素和免疫功能中起重要作用,这表明宿主利用健康的微生物群来最大化适应能力。肠道微生物生态系统的组成受到环境因素(如饮食和药物)的深刻影响,因此,与现代化相关的肠道生物多样性的丧失对人类健康构成威胁。尽管有越来越多的证据表明,微生物群失衡(菌群失调)会引发跨体细胞组织的生理反应,但关于微生物群扰动对生殖细胞的影响知之甚少。为研究这一点,研究者们在同基因型雄性小鼠中建立了一个诱导性肠道微生物群失调模型,使用不吸收的抗生素(nABX)自由进食。这些nABX不能穿过胃肠道上皮,因此任何生殖反应反映的是肠道微生物群的急性扰动,而不是全身药物暴露。通过16S核糖体RNA测序显示,6周低剂量nABX处理导致肠道微生物群的多样性、丰度和丰富度显著降低,这一效应是可逆的,在停药8周后逐渐恢复。6周nABX导致的菌群失调对雄性小鼠的体重、繁殖能力或存活率没有显著影响。此外,使用质谱法在循环血清和睾丸中未检测到nABX,确认其特异作用于肠道。
1. 肠道微生物失调父本小鼠的后代特征
为了评估诱导的肠道菌群失调对后代的影响,研究者们将nABX处理的雄性小鼠与未处理的雌性小鼠交配,并对F1代的表型进行评估。结果发现,与对照组相比,nABX处理的父代所生的后代新生儿出生体重显著降低(P = 0.023),且无论是雌性还是雄性后代都受影响(图1)。此外,nABX父代所生的F1代平均体重在整个出生后发育阶段显著较低。此外还观察到由菌群失调父代所生的后代中出现了严重生长受限(SGR)的现象,其体重Z评分低于-3,这在对照组中未见(图1)。统计显示,nABX处理的后代发生SGR的几率显著增加(OR = 3.52)。更显著的是,nABX处理的父代所生的F1代后代显示出显著增加的出生后死亡率(P = 0.0002),尤其是发生在SGR后代中,表明高死亡率与F1代的生长受限易感性增加有关。独立nABX雄性小鼠父代所生的SGR后代的转录组分析显示,通过主成分分析(PCA),这些后代聚集在一起并与对照组后代分开,表明F1代分子反应具有可重复性(图1)。在F1代脑和棕色脂肪组织(BAT)中分别检测到2973和1563个差异表达基因(DEGs),这些DEGs在代谢过程相关的反应途径中富集。数据支持nABX介导的父系菌群失调对后代生长、代谢网络和生存的代际影响。这些表型表现为对父代状态的概率性反应,而不是确定性反应。随后,研究者们研究了其他方式的父系菌群扰动是否也会引起F1代的响应。首先,使用另一种抗生素组合(avaABX),观察到avaABX处理的父代也会增加F1代后代的体重下降(SGR OR = 7.0)和死亡率(P = 0.014)(图1)。其次,通过使用渗透性泻药(PEG)进行胃肠道清洗,诱导广泛的菌群失调,结果显示,PEG处理的父代所生的后代也显著体重较低,SGR易感性增加(OR = 5.8)且早期死亡率提高(图1)。这表明,父系肠道菌群的多种不同扰动增加了后代发育障碍和早期死亡的风险,支持了诱导的父系菌群失调与后代健康之间的直接联系。
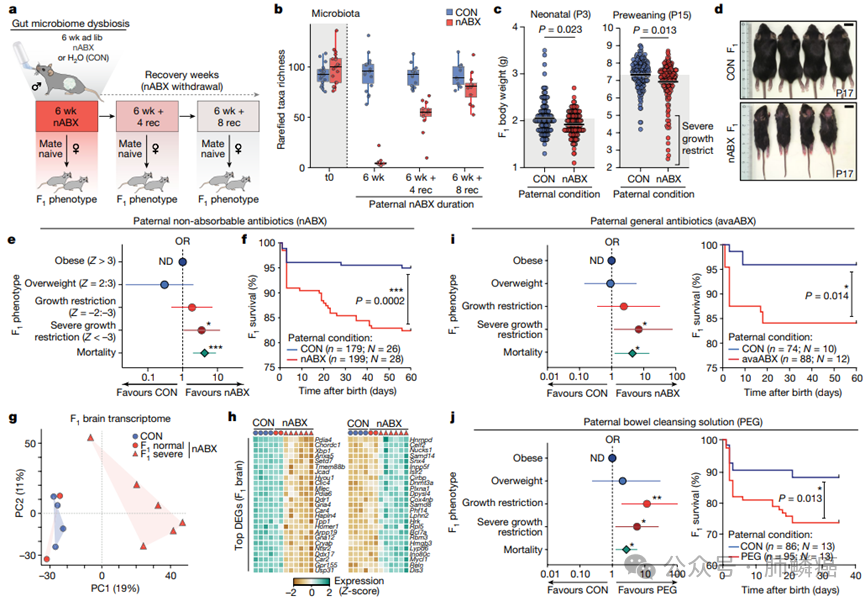
图1:父系肠道微生态失调可能触发F1表型的变化。
2. 父系影响的可逆转性
研究者们接下来研究了父代肠道菌群恢复是否能挽救F1代的表型效应。经过4周的nABX停药期(6周+4周恢复期),父代菌群仍显著失调,F1代新生儿体重仍显著较低,SGR易感性增加,生长受损(图2)。然而,在8周nABX停药期(6周+8周恢复期)后,随着父代菌群的恢复,F1代新生儿体重和正常发育恢复正常,SGR易感性和过高死亡率也消失(图2)。这表明F1代效应在父代菌群失调期间持续存在,但随着父代肠道菌群和一个生精周期(约5周)的恢复而可逆。值得注意的是,转录组分析显示,由6周nABX父代产生的SGR后代与6周+4周恢复期父代的后代基因富集高度相似,表明在父代菌群失调窗口期受孕的后代表现出一致的分子表型,暗示共同的潜在病因(图2)。此外,SGR后代的基因组测序未显示相对于对照组的突变负荷增加,也未发现结构变异、单核苷酸多态性(SNPs)或小插入和缺失(INDELs)的显著差异,且未检测到F2代效应(图2)。这些数据表明,由菌群失调父代引起的F1代表型效应并非由于遗传差异传递,也不超越第一代传播。
3. 父本肠道微生物对子代表型影响的机制。
为研究代际遗传方式,研究者们首先探讨了菌群失调是否通过父代传递。结果发现产后母鼠的微生物群无显著变化,父代暴露未影响母鼠微生物群。交配后母鼠和后代的微生物群也无显著差异,表明父代改变的微生物群未传递给母鼠和后代(图2)。后代的表型与父代的微生物群相关,而非自身微生物群。接下来,研究者们进行了共居实验,让雌鼠与对照或nABX雄鼠共居但与未处理雄鼠交配,发现后代的出生体重、成长和存活率无差异,排除父代微生物群改变和母鼠间接反应对F1代效应的影响(图2)。接着我们通过体外受精(IVF)研究F1代表型是否通过父代配子传递。将nABX处理和对照雄鼠的精子分别与同基因型卵子结合,并植入高质量CD1代孕母鼠中,排除任何亲代接触。结果显示,由菌群失调精子捐献者产生的IVF后代新生儿体重显著降低,出生后生长受损,SGR发生率增加(图2)。使用BL6代孕母鼠的独立IVF实验也再现了这些效应。数据表明,父代诱导的F1代表型在不同子宫内遗传背景下产生,主要通过配子和共纯化分子传递。
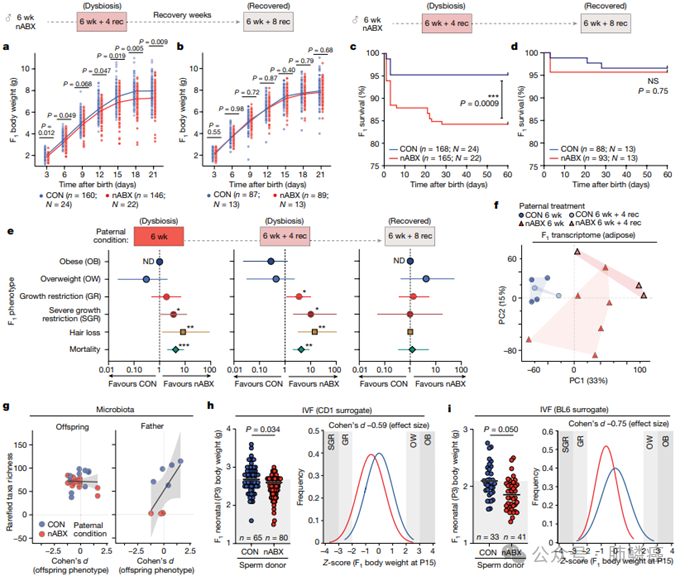
图2:父本肠道微生物群的恢复挽救了对F1的表型
4. 肠道-生殖轴的发现
由于通过生殖系传递,研究者们研究了急性肠道菌群失调对父系生殖系统的生理影响。研究发现,经过6周nABX处理的雄性小鼠的睾丸质量显著小于对照组,且精子数量减少(图3)。组织学分析显示部分生精小管结构异常,包括因部分生殖细胞丧失而形成的空泡,这在对照组睾丸中未见。此外,nABX雄性小鼠的异常睾丸小管数量显著增加,表皮厚度减少(图3)。这些数据表明,肠道菌群扰动影响睾丸生理。为了表征失调对生殖系统的分子响应,研究者们首先进行了父系睾丸的非靶向代谢组学分析,注释了3803个特征。代谢物的主成分分析(PCA)显示,睾丸根据肠道菌群状态分组,nABX和对照雄性小鼠在6周和6周+4周恢复期内清晰分离,表明在传递F1效应期间代谢物发生变化(图3)。相反,6周+8周恢复期的睾丸代谢组学特征无明显差异,表明代谢物随肠道菌群恢复而动态恢复,并伴随F1效应的逆转。接下来,研究者们在失调雄性小鼠的睾丸中鉴定了68种差异代谢物,包括内源性大麻素通路的花生四烯酸和信号脂质鞘氨醇-1-磷酸(S1P)。这些代谢物特别富含鞘脂、甘油磷脂和内源性大麻素,这些都与生殖细胞功能有关。转录组分析显示,失调雄性小鼠的睾丸中甘油磷脂和类固醇生成相关基因优先失调,最敏感的基因是瘦素(Leptin),其在能量稳态和生殖中具有关键作用(图3)。通过酶联免疫吸附试验(ELISA)验证了nABX介导的菌群失调导致循环血液和睾丸中的瘦素水平显著降低(图3)。进一步研究显示,6周龄Leptin-null(ob/ob)小鼠的睾丸重量减少,精子数量和小管结构异常,与6周nABX雄性小鼠类似(图3)。IVF实验表明,瘦素缺乏的父系对后代基因表达具有跨代影响。综上所述,这些数据表明,瘦素在肠-生殖轴中的重要作用,并且nABX介导的菌群失调通过影响瘦素在父系和后代之间传递代谢和激素变化。
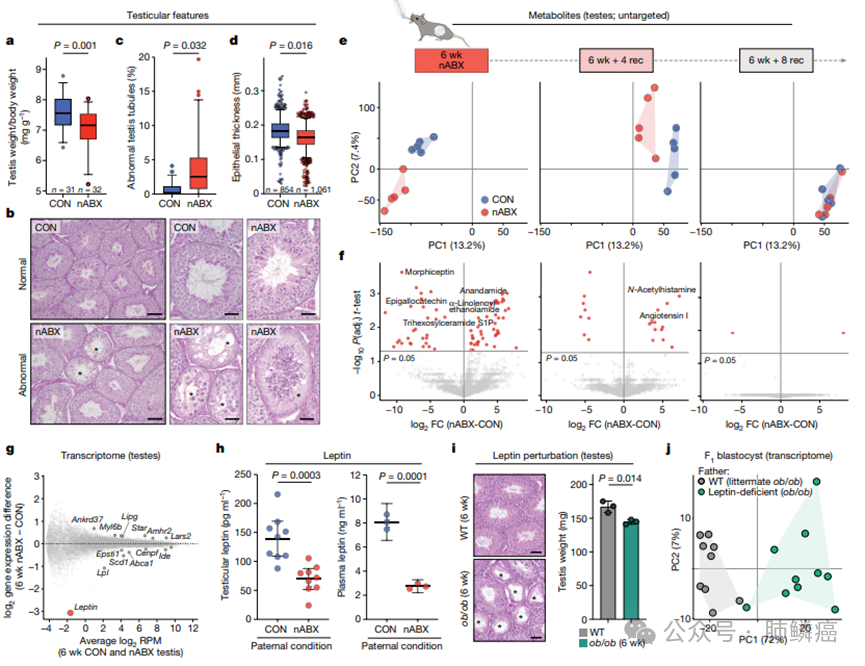
图3:睾丸对肠道微生物群失调的反应表明存在调节性肠道-生殖系轴。
5.肠道微生物失调父亲子代的胎盘反应
为了理解精子如何影响后代表型,研究者们首先研究了胚胎缺陷的最初来源。在妊娠中期(E13.5),nABX处理雄性小鼠所生的胚胎与对照组相比没有差异表达基因(DEGs),胚胎转录组在主成分分析(PCA)中无明显区分。然而,E13.5胎盘的转录组根据父代nABX处理情况显著分组,显示538个DEGs,包括多种催乳素基因的下调。E18.5成熟胎盘的转录组也根据父代微生物群状态分组,有348个高置信度DEGs,上调的DEGs富含类固醇代谢相关基因,下调的DEGs与糖酵解相关(图4)。此外,多个与胎盘发育重要因子如Hand1和Syna的下调,提示胎盘发育受损。研究者们发现E18.5胚胎相对于胎盘的质量比例在nABX雄性小鼠所生的F1代中显著变化,主要是由于胎盘质量减少,这与由菌群失调父代引起的胎盘缺陷一致(图4)。为了解这种现象的分子病因,研究者们注意到nABX来源的胎盘中,前十个DEGs包括多种人类胎盘功能不全疾病的临床标志物,例如子痫前期。Plgf在菌群失调父代所生的成熟胎盘中显著下调,而子痫前期标志物如Flt比率、Clu和Afp则上调(图4)。进一步研究发现nABX父代所生的胎盘迷宫区显著缩小,这是胎盘功能障碍的常见原因。我们还发现胎盘血管化显著受损,胎盘梗塞增加。最后,我们检测了胎盘生长因子(PLGF)水平,发现nABX或avaABX处理雄性小鼠所生的胎盘中PLGF显著降低,而sFLT/PLGF比率显著升高(图4)。综上所述,这些数据表明,菌群失调的父代通过影响胎盘发育和功能,引发后代的发育障碍。

图4: 父本肠道微生物失调诱发F1胎盘功能不全。
简评
本研究第一次鉴定了肠道-生殖轴,发现父系肠道微生物群的改变可以显著影响后代的健康和发育。研究详细展示了通过抗生素处理诱导的父系菌群失调如何导致后代出现各种负面结果,包括新生儿出生体重降低、生长轨迹受损、严重生长受限的易感性增加以及出生后死亡率提高。这些发现强调了父系微生物群在塑造后代健康方面的关键作用,揭示了代际健康影响的一个之前未被充分认识的方面。这项工作推动了我们对肠-生殖轴及其对生殖生物学和后代健康影响的理解,开辟了探索基于微生物群的疗法和预防措施的新途径,以提高生殖成功率和代际健康。
——Wang Bokai
原文链接:
https://www.nature.com/articles/s41586-024-07336-w
点击文末 “阅读原文” 即可查看
参考文献:
Argaw-Denbob et al. Paternal microbiome perturbations impact offspring fitness. Nature May 1st
转载须知
【原创文章】“肺鳞癌”原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为“肺鳞癌”所拥有。“肺鳞癌”保留所有法定权利,违者必究。转载及合作:jianl@intl.zju.edu.cn